新着情報
再生医療とは?日本の再生医療市場の現状および今後の展望を解説
従来の医療だけでは対応が難しい疾患の新たな治療法として期待されているのが「再生医療」です。再生医療は、体内の細胞や組織の再生能力を活用し、損傷した部位を根本から修復するという治療法です。特に日本では、iPS細胞をはじめとした先進的な再生医療研究が進み、実用化に向けた制度整備や民間の再生医療分野への新規参入が進められてきました。しかし、現状再生医療の市場は当初想定されていたほどは大きくなっていない状況です。
この記事では、まず再生医療の基本的な概念や期待される効果、日本および海外の再生医療市場の現状や今後の見通しについて解説します。
1.再生医療とは
再生医療とは、損傷した組織や臓器の機能を回復させることを目的に、細胞や遺伝子を利用して治療を行う医療分野です。特に、日本では細胞を用いた治療法が注目されており、従来の薬物療法や手術では対応が難しかった疾患への新たなアプローチとして期待されています。
中でも、iPS細胞やES細胞といった多能性幹細胞は、さまざまな体細胞に分化できる能力を持ち、理論上はあらゆる組織への分化が可能であり、再生医療への応用が期待されています。また、造血幹細胞や脂肪由来の間葉系幹細胞(MSC:Mesenchymal Stem Cells)といった組織幹細胞も、特定の細胞系統に分化する能力を持ち、すでに一部は治療に実用化されています。
一方で、倫理的課題や安全性、コストの問題も存在しており、今後の社会実装には慎重な検討が求められています。
2.再生医療に期待されていること
再生医療は、これまでの医療では対応が難しかった疾患に新たな選択肢を提供するものとして注目されています。身体への負担が少ないことや、疾患の根本治療につながる可能性、さらには治療困難とされている病気や外傷にも有効性がある点が期待されています。
2-1.より身体への負担が小さい治療
再生医療の特徴の1つは、治療にともなう身体的負担が少ない点にあります。従来の外科手術では、メスを入れることによる出血や術後の回復期間が必要でした。一方、再生医療では、患者自身から採取した細胞を培養・加工して体内に戻すという治療法が多く、大がかりな外科手術を必要とせず、注射などの低侵襲な方法で実施できるケースもあります。
身体を大きく傷つけずに治療を行える再生医療は、高齢者や持病を抱える患者にとっても適応しやすい治療法とされています。また、侵襲性が低いほど手術による感染症や術後合併症のリスクも軽減できるため、回復期間の短縮や生活への早期復帰が見込める点もメリットです。
2-2.疾患の根本的な治療
再生医療は、従来の薬物療法や対症療法では対応が難しかった疾患に対して、根本的な治療を目指す新たな医療アプローチです。損傷した組織や細胞を再生・修復することで、症状を一時的に抑えるのではなく、原因そのものの解消を目指します。
例えば、関節の軟骨がすり減ることで起こる変形性関節症では、痛みを和らげるための鎮痛剤投与が一般的でした。しかし再生医療では、軟骨細胞を培養し注入することで、損傷部位を再生するアプローチも可能です。
ほかにも、心筋梗塞や脳梗塞などによって壊死した組織に対しても、幹細胞などを活用して再生を促すことで、慢性疾患や後遺症の軽減に期待できます。
症状を根本から改善できれば、患者のQOL改善にもつながるでしょう。
(※QOL:「生活の質」のこと。医学の領域では、「病気や加齢によりそれまで通りの生活ができなくなった人が、これでいいと思える生活の状態のこと」を指します。)
2-3.従来は難しかった病気や怪我の治療
再生医療の進展は、治療の選択肢を広げるだけでなく、これまで治療対象とされてこなかった疾患や症状にも応用され始めています。特定の臓器や組織に限らず、神経・筋肉・皮膚・骨など、多様な組織の再生に対応可能となりつつあり、その応用範囲はますます拡大しています。
例えば、重度の火傷は従来、痕跡を残さずに治療するのが困難でしたが、細胞を培養して作製した皮膚を移植することで、患者自身の皮膚再生を促し、自然な外見への回復を目指す治療が実現しています。
また、難治性の歯周病や歯の欠損に対しても、差し歯や入れ歯といった従来の方法に加え、歯髄幹細胞などを用いた再生治療の研究が進められています。
3.再生医療市場の現状
大きな期待が寄せられている再生医療の市場は、一方で現状は伸び悩みがみられる状況です。
2012年の時点で、約170億円だった国内の再生医療市場の規模は、2020年には950億円に達すると予測されていました。しかし、2022年の時点で、国内の再生医療の市場は約298億円であり、予測との差が生じています。
出典:内閣府「国内外の再生医療の周辺産業の将来市場規模予測」
出典:再生医療相談室「アジアの再生医療・細胞治療の最新治療動向と法規制・ガイドライン分析2023」
ただし、2024年度には、再生医療の治療を受ける患者数が2017年度の2倍以上に増加し、自由診療を含めた提供施設も全国的に拡大しています。さらに、再生医療等製品の上市数も着実に増加しており、2017年には4製品にとどまっていたものが2023年には20製品と5倍に拡大しました。こうした動向を踏まえると、国内の再生医療市場は今後さらに成長していく可能性が高いと言えるでしょう。
出展:厚生労働省「再生医療等提供状況(令和6年度定期報告とりまとめ)」
また、諸外国における再生医療市場の伸び率は大きく、2024年は267億米ドル(1ドル=140円で換算した場合、日本円で約3兆7380億円)もの市場が生まれている状況です。
出典:株式会社グローバルインフォメーション「再生医療の市場レポート:タイプ別、用途別、エンドユーザー別、地域別、2025年~2033年」
日本および諸外国における再生医療市場の現状は、以下の通りです。
3-1.日本における再生医療市場の現状
日本の再生医療分野は、iPS細胞をはじめとする先進的な研究開発により、世界でもトップクラスの技術水準を誇っています。京都大学や大阪大学、慶應義塾大学などの研究機関とベンチャー企業が連携し、臨床応用を見据えた研究が加速している状況です。また、自由診療の分野では、PRP療法(広義には再生医療の一部とされる)や幹細胞を用いた美容・関節治療、免疫細胞療法への需要が伸びており、再生医療に関連する民間市場の広がりも見られます。
一方で、製造コストの高さ、法律・規制制度の複雑さ、収益化までの期間の長さといった課題が存在します。
法規制では、遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律(カルタヘナ法)や生物由来原料に関する法規制が再生医療実用化のスピードを遅らせているため、柔軟な運用や基準の見直しが必要です。また、最新技術の活用が進む一方、技術自体に品質や機能の改善が求められています。
2014年には、安全性確保法(安確法)や薬機法に基づく特例承認制度が施行され、世界に先駆けて再生医療等製品の早期承認を可能にする制度が整えられました。しかしながら、制度の整備が進んだ一方で、実際の製品化や社会実装には多くの課題があり、研究と産業の橋渡しが依然として大きな課題となっています。大学・企業・医療機関の連携体制や専門人材の育成、製造・流通インフラの整備に加えて、長期的な有効性・安全性データの蓄積、保険・価格制度の整備、製造コストの低減、医療現場や患者への情報提供など、多方面での取り組みが求められています。
一方で、自由診療による再生医療に対する懸念も拭いきれません。現状、医療体制がひっ迫するなか、再生医療は先進医療として、自由診療のかたちでの提供が期待されています。しかし、研究段階を超えた未承認の再生医療を自由診療として受けられるケースも存在し、その中には科学的根拠に乏しい治療や適切な審査を経ていない医療が含まれることがあります。実際に不適切な再生医療が提供され、健康被害につながる事件も報告されており、国際幹細胞学会(ISSCR)などからは、安全性と倫理性に対する懸念が表明されています。
また、医療施設の認定制度が未整備であるため、医療機関ごとの品質管理の手間が増え、国内外で製品が利用されるまでに時間がかかっていました。さらに、細胞製品は患者ごとの個体差により規格外品が発生しやすく、規格外品をすばやく患者へ提供できる仕組みも不足しています。製品の輸出入に際しても手続きが複雑で、時間がかかり、治療機会を逃すこともあります。
加えて、専門知識や技術を持った人材が不足しているため、国内での製造能力や競争力が十分ではないことも問題です。規制緩和の遅れや製造力・競争力の不足が原因で、日本においては再生医療市場が予測よりも伸び悩む状況が起こっています。
3-2.諸外国における再生医療市場の現状
諸外国では、再生医療の実用化と産業化を見据えた戦略的な取り組みが進められています。特に、基礎研究と臨床応用の中間段階である「橋渡し研究」の支援に重点が置かれており、公的機関が民間の不足部分を補完する仕組みが整えられています。
| アメリカ |
|---|
| 連邦政府と州政府が一体となり、巨額の研究資金の投入やエコシステム整備を進めています。マサチューセッツ州のMLS Centerでは、インフラ提供や産学連携の強化により、再生医療分野の競争力強化が図られています。 |
| イギリス |
|---|
| 産業界との連携と、アカデミア由来のシーズを支援する二本柱の体制が構築されています。政府は、民間では対応が難しい中長期的視点の支援を行い、NHS(国民保健サービス)を活用した臨床試験の効率化も推進しています。ケンブリッジやオックスフォードなど、世界有数の大学と製薬企業が集積する研究基盤も強みとされています。 |
| ドイツ |
|---|
| 欧州医薬品庁と連携した厳格な規制体制のもと、再生医療研究を推進。GMP対応の高度な製造施設を有し、幹細胞や遺伝子治療分野での安全性と品質管理が強みです。ベルリンやミュンヘンを中心に学術機関と企業の連携が進んでいます。 |
| 中国 |
|---|
| 国家主導の人材招致政策や財政的優遇措置により、研究機関・企業の集積を進め、再生医療におけるエコシステムの確立を目指しています。2023年時点で130品目を超える臨床試験が進行しており、CAR-T細胞療法や幹細胞治療を中心に、今後の市場拡大が期待されています。 |
| 韓国 |
|---|
| 規制と市場化のバランスを重視し、臨床応用の迅速化を推進。世界初の幹細胞治療薬 Cartistem® を承認し、美容・整形分野への応用も活発です。政府主導で商業化支援が進められ、再生医療のビジネスモデル構築に注力しています。 |
各国は再生医療の持つポテンシャルを生かすため、研究から産業化に至るプロセスを制度・資金・人材の面から戦略的に支援しています。
4.日本の再生医療市場の展望
日本の再生医療は、これまで主に基礎研究および臨床研究を中心に発展してきましたが、今後は治療用細胞の多くが治験段階へと進み、製造販売承認や商用化に向けた取り組みが加速すると見込まれています。再生医療等製品の承認品目数が増加し、医療現場での活用も拡大することで、再生医療普及が進み、市場も拡大すると期待されています。その成長を加速させるためには、いくつかの重要な課題への対応が不可欠です。
| 課題 | 主な対応策 | 意義・期待される効果 |
|---|---|---|
| 保険適用の拡大 | ・高額な自由診療に限られていた再生医療製品への保険償還の拡大 ・2026年の医療報酬改定に向けた、費用対効果や持続可能性を考慮した価格制度の見直し(出典:厚生労働省「再生医療等安全性確保法改正について」) | ・患者の経済的負担軽減によるアクセス改善 ・再生医療の臨床応用の拡大(より多くの医療現場での活用が可能に) |
| 製造技術の自動化と標準化 | ・再生医療製品における製造工程の自動化による品質の均一化 ・製法の標準化を通じた製造効率の向上 ・CDMO(医薬品開発・製造受託機関)での人材育成や設備投資、スケールアップ対応 | ・個別最適化製品に対応する効率的かつ持続可能な製造体制の構築 ・コスト削減と製品の品質安定化 ・再生医療の産業化・大量供給に向けた基盤強化 |
| 研究成果の社会実装 | ・アカデミア・産業界・臨床現場の連携による研究開発推進 ・スタートアップやベンチャーへの支援 ・実証フィールドの提供を通じた社会実装の促進 ・産学医連携体制の強化 | ・研究成果の事業化・収益化 ・再生医療の普及促進 ・研究と産業の橋渡しを支えるイノベーション・エコシステムの形成 |
| 国際展開と海外市場へのアクセス | ・輸出体制の整備による海外展開の促進 ・国際品質基準への対応 ・治療実績や安全性データの蓄積による信頼性向上 | ・日本の技術優位性を活かした国際競争力の強化 ・アジア・欧米市場への展開 ・海外承認取得の促進 |
| 倫理・規制対応の整備 | ・再生医療等安全性確保法の改正による対象拡大(例:核酸・遺伝子治療の追加) ・認定再生医療等委員会への立入検査規定の整備など、審査体制の強化 ・技術革新に対応した倫理的配慮と透明な規制の両立 | ・審査体制の信頼性向上 ・技術革新とのバランスをとった持続可能な制度運用 ・国民・患者からの信頼の獲得 |
このように、今後の日本の再生医療市場は、研究段階から製造・商用化段階までの一貫したサポート体制の確立と、法制度・価格制度の整備によって、グローバル市場への展開も視野に入れた本格的な成長期を迎えると見込まれています。
まとめ
再生医療は、細胞レベルでの修復を可能にする次世代の医療として、国内外で将来性の高い分野と評価されています。近年は、iPS細胞や幹細胞を用いた治療が実用段階へと進みつつあり、日本においても研究から治験、商用化に至るプロセスが着実に進展している状況です。
一方で、法規制、医療制度、技術的課題など、複数の要素が再生医療の発展に影響を与えており、市場の成長を正確に予測することは容易ではありません。産業としての確立には、引き続き慎重な姿勢と段階的な発展が求められます。
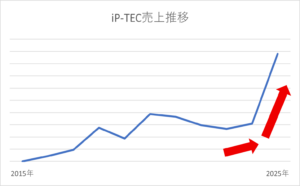
それでも、再生医療の社会実装が進む中で、治療現場および研究機関におけるニーズは着実に拡大しています。これに伴い、細胞の培養・輸送・保存・投与に関連する装置・資材・ソフトウェアなど、再生医療のインフラを支える製品群への需要は、品質保証やGMP対応を前提とした形で高まり続けています。特に、治療や患者ごとの個別化治療に対応するための柔軟な設計や高精度な制御機能が求められており、今後もその市場拡大が見込まれます。そうした中、再生医療における非凍結輸送(ライブ輸送)用容器や輸送デバイスを取り扱うiP-TEC©の売上も順調に推移しています。これは、再生医療の産業化が現実味を帯びてきている証といえるでしょう。
今後は、再生医療製品の安定供給体制の構築や品質管理の高度化が進むことで、患者がより安心して治療を受けられる体制が整っていくと期待されます。
そうした中で、iP-TEC©にも治療用細胞向けの容器開発についてご相談いただく機会が増えています。こうしたニーズに応えるべく、細胞輸送や培養に適したオーダーメイド容器の開発を強化しています。今後とも、デザインや機能性、ユーザビリティなどバランスのとれた設計、最適な樹脂選定など弊社の強みを生かしたソリューションを提案してまいります。ぜひお気軽にご相談ください。


